







近日CDISC成功举办了2021线上中国年会,圣方医药研发统计编程总监谢蒙生以“中国数据递交之aCRF自动化Automation of aCRF for NMPA Submission”为题分享了圣方医药研发在aCRF自动化方向的经验心得。
我们将线上的视频内容整理成文字版,通过介绍CRF的不同类型、两国监管机构对aCRF的不同要求、注释CRF的关键元素以及圣方医药研发自主开发的工具使其自动化实现,尝试解释清楚aCRF生成的流程和关键步骤。
aCRF的介绍和自动化实现
注释病例报告表(aCRF)是向药物监管机构递交数据材料的必要文件之一,体现了病例报告表(CRF)收集的数据和递交原始数据间的映射关系。美国食品药品监督管理局(FDA)和国家药品监督管理局(NMPA)对新药临床试验中数据递交要求不同,对应的aCRF要求也不相同。
1.CRF的类型
在获取方案和具体要求后,由数据管理部门负责撰写CRF初稿。CRF初稿经过修改和审阅后,由EDC建库人员在系统中建立数据库。
在建库完成后,通过太美医疗科技的EDC可以导出4种不同的CRF类型,按是否包含所有访视和是否包含EDC字段注释信息分为:unique blank CRF, unique annotated CRF, entire blank CRF和entire annotated CRF。需要注意的是,entire表示包含所有访视,annotated表示包含EDC字段注释信息。
Unique blank CRF包含字段组和字段的信息,并不包含访视信息。多个访视中重复的CRF页,将只显示一次。字段组默认按采集时间排序。
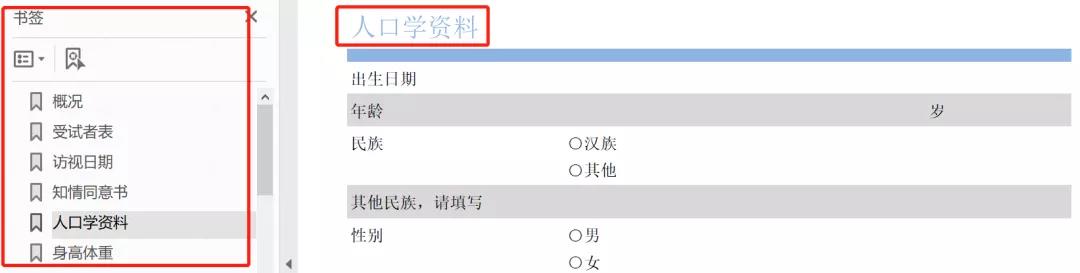
Unique annotated CRF包含字段组和字段的信息,同样不包含访视信息,但包含EDC字段的注释信息,并提供了链接。链接的位置可以为自动化注释CRF提供位置信息。

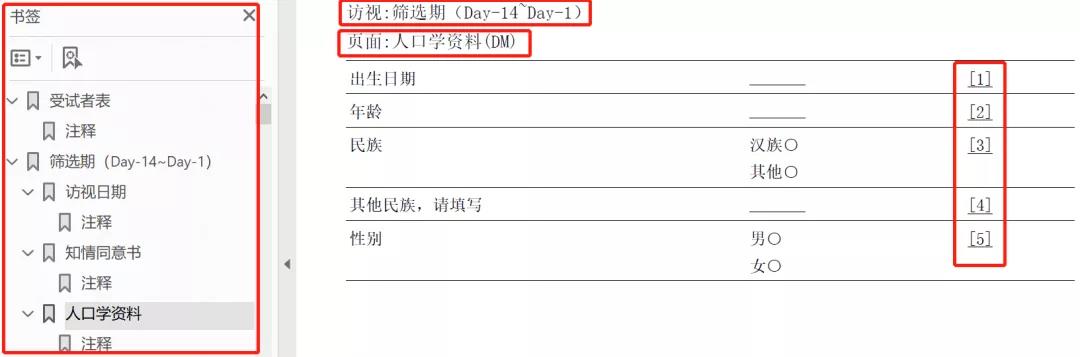
Entire annotated CRF包含了字段组,字段和访视信息,同样包含了EDC字段的注释信息。该CRF中的访视信息,为自动化aCRF提供书签信息。
2.递交要求
FDA对递交的aCRF做出了规定,在研究数据技术一致性指南(STUDY DATA TECHNICAL CONFORMANCE GUIDE)中,对aCRF提出了以下要求:
1. aCRF is a PDF document,
2. Maps the clinical data collection fields to the corresponding variables within SDTM datasets,
3. Named as aCRF,
4. For the data are collected but not submitted, the CRF should be annotated with the text “NOT SUBMITTED” and explain in SDRG.
目前,向FDA递交的原始数据默认为SDTM格式,CDISC在SDTM元数据递交指南(SDTM Metadata Submission Guidelines (SDTM-MSG))中也为aCRF的递交做出了更明确的规定。具体规定如下:
1. aCRF is located in SDTM folder in M5,
2. In PDF format named as blankcrf.pdf,
3. All unique CRF pages or forms should be annotated to match the SDTM datasets and variables,
4. Unique or entire CRF with dual bookmarks,
5. Text-based and searchable,
6. Text should be capitalized,
7. Not obstruct any text on CRFs,
8. Domain level annotations slight larger than variable level,
9. Color coded for different domains on the same page.
目前,向NMPA递交的数据尚未强制符合CDISC标准。原始数据的递交就存在符合SDTM标准和不符合SDTM标准两种情况。我们建议,如果递交的数据符合SDTM标准,则aCRF建议符合向FDA递交的标准。
如果原始数据不符合SDTM标准,则aCRF需要反映原始数据和收集字段之间的关系。在《药物临床试验数据递交指导原则》中,对aCRF的递交要求总结如下:
1. 空白CRF,反映采集的受试者数据与递交原始数据的映射关系,
2. PDF文件,
3. CRF收集的数据,在递交的原始数据集中未包含的,应该注释为“不递交”。
3. 关键元素
根据FDA和NMPA对aCRF递交的要求,可以总结为以下几个关键元素:
1. 在空白CRF上进行注释,
2. 注释内容,反映映射关系,
3. 注释元数据,
1) 注释位置,
2) 注释内容的字体,大小和对齐,
3) 字体和边框颜色,
4. 双重标签。
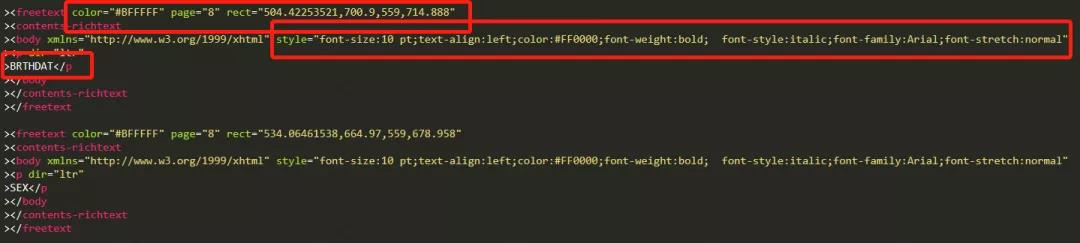
在手动注释aCRF完成后,注释内容和注释元数据均会在PDF文件中以XFDF文件体现。
XFDF (XML Forms Data Format) 是用于在PDF文档中表示表单数据和注释的一种格式。XFDF是表单数据格式 (FDF)的XML版本,它是PDF的简化版本,用于表示表单数据和注释。自动化生成XFDF文件也是自动化生成aCRF的关键。
4.工具
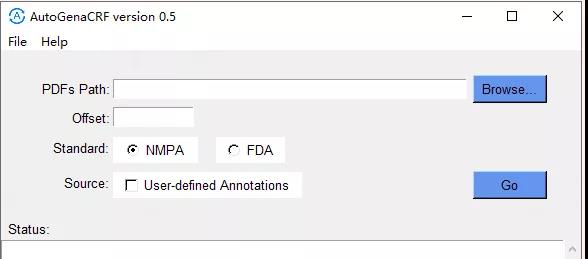
圣方医药研发自主开发了工具Automatic generation aCRF可以自动化生成aCRF, 一键生成符合NMPA和FDA两种格式的aCRF,工具的用户界面截图如下:
工具将读取以下文档并利用其中关键信息,调用python和SAS程序,在unique blank CRF上进行注释,自动生成aCRF。
1. Unique blank CRF,
2. Unique annotated CRF,
3. EDC data structure,
4. Entire blank CRF,
5. SDTM Mapping Library.
为了符合递交要求,工具会进行多重检查,比如文档间的一致性核查,文档和数据集的一致性核查,SAS logs核查,SAS数据集的变量名和标签是否符合规则的核查等一系列核查。
在向NMPA递交的数据中,如果数据不满足递交要求,工具也可以按设定规则转换数据,并生成新的数据结构表以满足递交要求,注释内容反映了递交数据和CRF收集字段之间的关系。
自动化工具首要是为服务效率提升,而非提升品质,至少不直接服务于品质的提升。能做出更好品质的aCRF,离不开对CDISC的深刻理解。
尾 声
在国家大力倡导创新药物的背景下,符合CDISC标准的数据以及相关附件的生成也将会成为趋势。在数据流向明确的新药临床试验中,建立标准CRF库,以及之后的标准映射关系库将会较大程度地提升注释CRF,SDTM数据集和define.xml的生成效率。
太美医疗科技eCollect (EDC), 提供符合CDASH标准的中英文快速建库服务,为圣方医药研发生物统计部门实现了eCollect采集数据符合NMPA和FDA标准的原始数据递交和自动化转换。

