






标准化工作是医疗信息化建设和医疗大数据应用的一项基础性的系统工程。临床研究领域中底层数据标准制定是加强行业数据交流,缩短研究周期,减少研究费用,引领临床研究高质量发展,提升中国医药创新水平的重要基础性工作之一。

近日,圣方(上海)医药研发有限公司受中国医学科学院肿瘤医院邀请成为专家组成员之一,支持共同完成《恶性肿瘤临床研究数据采集标准》的通则部分。该数据标准将成为恶性肿瘤临床研究数据地方标准,提供完整及高质量的真实世界数据规范与标准。圣方医药研发支持中国医学科学院肿瘤医院在采集标准、术语标准、编码、元数据集等方面的编写工作。
标准化春潮已至 圣家人奋楫扬帆
随着医药产业的蓬勃发展和相关部门监管力度的加强,科研人员对临床研究的重视程度不断增加,临床研究项目迅速增多。近年来,我国肿瘤相关的药物临床试验数量增长迅速,仅2020年内就有722项相关研究开展,共涉及458种抗肿瘤药物。根据《药物临床试验数据递交指导原则》开展临床试验数据标准化工作势在必行,该数据标准的发布将大大提高数据质量、加快药物研发的周期、缩短药物评审周期。
2021年1月,首都标准化委员会印发《推动首都高质量发展标准体系建设实施方案》,开启了首都高质量发展标准体系的建设;同年9月,北京市市场监督管理局发布《关于征集2022年北京市卫生健康标准修订项目的通知》,组织临床研究机构启动针对恶性肿瘤临床试验数据采集标准的申报和制定工作。
2022年初,北京市市场监督管理局又相继发布了关于征求对2022年北京市地方标准拟立项项目(第一批)/(第二批)意见的通知。圣方医药研发接到工作任务后抽调人员快速组建临床数据治理专项小组展开相关标准的撰写工作。
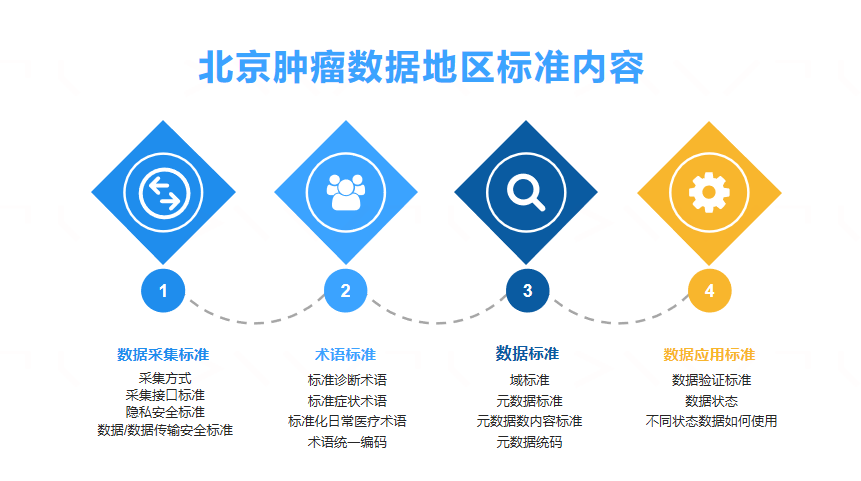
作为科技型全功能临床CRO公司,圣方医药研发旗下的真实世界研究团队旨在通过不断深化临床研究与医疗大数据和人工智能的结合,为行业推出有特色的数字化临床研究服务。针对此次北京恶性肿瘤临床数据标准制定的工作,专项小组明确了数据采集标准、术语标准、数据标准和数据应用标准作为本项目的重点内容。其中,数据采集标准包括采集方式、采集接口标准、隐私安全标准和数据/数据传输安全标准;术语标准包括标准诊断术语、标准症状术语、标准化日常医疗术语和术语统一编码;域标准、元数据标准、元数据数内容标准和元数据统码是构成数据标准的关键所在;而数据应用标准涉及数据验证标准、数据状态和不同状态数据如何使用。
同时,专项小组参考了多项国家与国际数据标准包括WS/T303卫生信息数据元标准化规则、卫生信息数据集分类与编码规则、GB/T 14396 疾病分类与代码、GB/T 18391.3 信息技术数据元的规范与标准化等,和国际临床试验标准如CDISC、OMOP等,形成了初版通用数据元+专病数据元。
对于此项目工作的开展,圣方医药研发此项目负责人冯育基博士表示,“随着信息技术的发展和相关法规的完善,医疗健康数据在临床试验领域的应用获得了越来越多的认可。数据标准是提高数据治理质量,促进临床数据发展与应用的基础。统一的数据标准使临床数据的采集和应用具有可预测性和一致性,从医院原有临床业务系统中海量的结构化、非结构化数据中提取符合科研需求、高质量的临床数据,并加强不同来源数据之间的互联互通,实现跨科室、跨医院、跨地区临床数据科研分析和交流共享。在标准统一规范的临床数据基础上,可以进一步建设临床数据与科研一体化的研究平台,满足临床科研,特别是多中心科研及专科专病研究的需求,让临床数据创造更大的价值。”

